L’infarctus du myocarde (IDM) de type 2 correspond à un déséquilibre fonctionnel entre apports et besoins du myocarde en oxygène, en l’absence de processus athérothrombotique, aboutissant à la nécrose myocardique. Il s’agit d’une pathologie fortement liée à l’âge. L’objectif de cette mise au point est d’en décrire les principales caractéristiques épidémiologiques, cliniques et pronostiques. L’IDM de type 2 est resté une pathologie méconnue des cliniciens jusqu’à la troisième définition universelle de l’IDM de 2017 qui l’a différencié de l’IDM de type 1, faisant suite à un événement athérothrombotique aigu. Cela explique que cette pathologie reste encore largement sous-diagnostiquée, alors qu’elle représenterait environ 20 % des IDM en population générale et pourrait concerner la majorité des IDM après 70 ans. Les patients présentant un IDM de type 2 ont un âge moyen de 81 ans (contre 67 pour les IDM de type 1), sans prédominance de genre. Cette pathologie touche de façon prédominante les personnes polypathologiques, avec notamment un terrain polyvasculaire fréquent. Toutefois, les pathologies aboutissant à cette situation de déséquilibre fonctionnel entre apports et besoins en oxygène sont majoritairement extracardiaques. Les pathologies chroniques prédisposant à l’IDM de type 2 le plus fréquemment retrouvées sont l’anémie sévère et le rétrécissement aortique serré. Les infections aiguës, respiratoires dans deux tiers des cas, représentent de loin le facteur précipitant le plus fréquent, suivies des tachyarythmies atriales (anciennement « fibrillation atriale anginogène »). Les IDM de type 2 sont associés à un sur-risque de mortalité par rapport aux IDM de type 1. Toutefois, la mortalité cardiovasculaire à court terme est similaire dans les deux types d’IDM. Les infections aiguës, en particulier respiratoires, représentent le facteur déclenchant le plus fréquent. Des études spécifiques sont nécessaires afin notamment d’évaluer la conduite à tenir diagnostique et thérapeutique. La grande hétérogénéité des facteurs étiologiques sous-jacents nécessite une approche globale, adaptée au cas par cas. Chez ces patients âgés polypathologiques, la collaboration entre le gériatre et le cardiologue permettra d’optimiser la recherche étiologique et la prise en soins des pathologies prédisposantes et des facteurs précipitants.
Mots clés :
Infarctus du myocarde – Syndrome coronarien aigu – Déséquilibre fonctionnel – Athérosclérose – Polypathologie
Alain PUTOT1,2, Sophie PUTOT1, Arthur HACQUIN2,3, Frédéric CHAGUE3,4, Yves COTTIN3,4, Marianne ZELLER3, Patrick MANCKOUNDIA3
1 Service de Gériatrie, CHU Sud Réunion, France.
2 Laboratoire Physiopathologie et Épidémiologie Cérébro-Cardiovasculaire – EA7460. Université de Bourgogne Franche Comté, France.
3 Service de Médecine Interne Gériatrie, CHU Dijon Bourgogne, France.
4 Service de Cardiologie, CHU Dijon Bourgogne, France.
Type 2 myocardial infarction (MI) corresponds to a functional imbalance between myocardial oxygen supply and demand, in the absence of any atherothrombotic process, leading to myocardial necrosis. It is a pathology strongly linked to age. The aim of this review is to describe the main epidemiological, clinical, and prognostic features of this disease. type 2 MI remained a poorly understood pathology among clinicians until the third universal definition of MI in 2017 that differentiated it from type 1 MI, following an acute atherothrombotic event. This explains why this pathology still remains largely underdiagnosed, although it would represent about 20% of MI in the general population and could concern the majority of MI after 70 years of age. Patients with type 2 MI have an average age of 81 years (compared with 67 years for type 1 MI), without gender predominance. This pathology predominantly affects polypathological individuals, with frequent cardiovascular history. However, the pathologies leading to this situation of functional imbalance between oxygen supply and demand are mostly extracardiac. The chronic pathologies most frequently found to predispose to type 2 MI are severe anemia and severe aortic stenosis. Acute infections, respiratory in two thirds of cases, are by far the most frequent precipitating factor, followed by atrial tachyarrhythmia (formerly “anginogenic atrial fibrillation”). type 2 MI is associated with an increased risk of mortality compared with type 1 MI. However, short-term cardiovascular mortality is similar in both types of MI. Acute infections, particularly respiratory infections, are the most frequent triggering factor. Specific studies are needed to evaluate the diagnostic and therapeutic management. The great heterogeneity of the underlying etiological factors requires a global approach, adapted to each case. For these polymorbid older patients, collaboration between the geriatrician and the cardiologist will optimize the etiological research and the treatment of predisposing pathologies and precipitating factors.
Keywords:
Myocardial infarction – Acute coronary syndrome – Functional imbalance – Atherosclerosis – Polymorbidity
L’infarctus du myocarde (IDM) est une pathologie particulièrement fréquente chez le sujet âgé : plus de la moitié des IDM et environ 80 % des décès en lien avec une cardiopathie ischémique ont lieu après 65 ans(1). Cette pathologie fréquente est la conséquence du développement de la maladie athéromateuse au sein des artères coronaires. L’âge en est le principal facteur de risque. En effet, les données autopsiques retrouvent ainsi une coronaropathie significative chez plus de 70 % des patients de plus de 70 ans(2). La vascularisation du myocarde étant de type terminal, l’occlusion complète ou partielle d’une de ces artères coronaires entraîne habituellement l’ischémie du territoire en aval. Dans la majorité des cas, l’IDM est donc lié à un phénomène athérothrombotique aigu au sein du réseau coronaire. Toutefois, ce mécanisme physiopathologique n’est pas unique. Dans 20 % des cas, les données autopsiques historiques d’IDM ne retrouvent pas de thrombose au sein de la coronaire vascularisant le territoire infarci(3). La notion d’IDM lié non pas à un phénomène mécanique d’occlusion coronaire, mais à une situation de déséquilibre fonctionnel entre apports et besoins en oxygène, dit de type 2, n’est apparue que tardivement dans la définition universelle de l’IDM(4). Malgré sa fréquence, en particulier en population gériatrique, l’IDM de type 2 reste une pathologie largement méconnue des cliniciens. Le concept de déséquilibre fonctionnel plurifactoriel à l’origine d’une situation aiguë pathologique est profondément gériatrique(5) et la prise en soin de ces patients ne devrait pas être limitée à une approche exclusivement cardiologique.
Athérosclérose, athérothrombose
L’athérosclérose est un processus silencieux progressif, s’aggravant avec l’âge, correspondant au développement de plaques d’athéromes au sein des artères de moyen et de gros calibres. Certainement influencée par des facteurs génétiques, elle est également accélérée par le cumul de facteurs de risque dits modifiables comme le tabagisme, la dyslipidémie, l’hypertension artérielle et le diabète sucré(6). Cette athérosclérose asymptomatique peut conduire à un accident aigu athérothrombotique, le plus souvent suite à la survenue d’une rupture de plaque et d’une thrombose secondaire. Si le thrombus est occlusif, en fonction du territoire artériel où il survient, la complication aiguë correspond le plus souvent à un accident coronaire aigu ou un accident vasculaire cérébral ischémique. Les artères coronaires ne sont pas les seuls vaisseaux à être touchés par ces phénomènes d’athérosclérose et d’athérothrombose. Pourtant, le myocarde est le seul muscle véritablement concerné en pathologie clinique par ces phénomènes ischémiques. D’une part, parce que la circulation est de type terminal, sans anastomose, à l’état physiologique, ne permettant pas de suppléance en cas de déficience du flux coronaire. Cela concerne autant la macrocirculation, c’est-à-dire les vaisseaux épicardiques, que la microcirculation. D’autre part, les besoins en oxygène y sont les plus importants de l’organisme, rapportés au poids, comparativement aux autres organes. Cette consommation est multipliée par près de 10 à l’effort7. Pourtant, l’extraction en oxygène du myocarde est d’emblée maximale au repos, contrairement notamment aux muscles squelettiques, ne permettant aucune adaptation en cas d’effort. La seule adaptation possible à l’augmentation des besoins est donc la modification du calibre de l’artère coronaire, qui via la libération par les cellules endothéliales de facteurs vasodilatateurs (en particulier le monoxyde d’azote) peut modifier en fonction des besoins d’un rapport 1 à 4 le débit au sein des artères coronaires(7). Pour augmenter l’apport en oxygène au myocarde, le seul mécanisme d’adaptation du débit coronaire est donc la vasodilatation. Toutefois, cette capacité de la coronaire à s’adapter aux besoins, appelée réserve coronarienne, et définie par le rapport entre le flux coronaire maximal à l’effort et au repos, est nettement altérée en cas de sténose coronarienne liée au processus athérosclérotique(8). De façon intéressante, en l’absence même de processus athérosclérotique, chez des sujets sans sténose coronarienne significative, l’âge est associé à un phénomène similaire de diminution de la réserve coronaire, c’est-à- dire de sa capacité à augmenter ses apports à l’effort(9). Des études chez l’animal ont montré que le vieillissement est associé à une diminution de la réactivité vasculaire, de la compliance artérielle et de la réponse aux catécholamines. Ces données montrent, du fait de l’âge d’une part, et de l’athérosclérose liée à l’âge d’autre part, que le sujet âgé est tout particulièrement exposé aux phénomènes d’ischémie myocardique fonctionnelle. Ceci est notamment lié à l’absence de réserve coronarienne possible pour le myocarde en cas d’augmentation brutale des besoins(9). Se surajoute à cette diminution des apports, une augmentation des besoins en oxygène à l’effort lors du déconditionnement cardiovasculaire, qui bien que non imputable à l’âge directement est particulièrement fréquent en gériatrie. Ce déconditionnement est notamment induit par l’alitement prolongé(10), fréquent chez le sujet âgé comorbide et en particulier en cas d’hospitalisation(11).
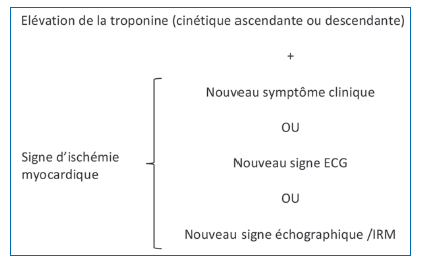
Le terme d’IDM correspond à des lésions myocardiques aiguës associées à des preuves cliniques d’une ischémie myocardique. Le diagnostic d’IDM répond à une définition bien précise, résumée dans la figure 1, et repose sur une cinétique des valeurs de troponines cardiaques (Tnc), avec au moins une valeur élevée (au-delà de la limite supérieure à la normale du 99ème percentile) et au moins une des conditions suivantes : symptômes d’ischémie myocardique, nouvelles modifications électrocardiographiques suggestives d’ischémie, apparition d’ondes Q pathologiques, perte récente de myocarde viable à l’imagerie ou nouvelle anomalie régionale de mouvement de la paroi du myocarde(12). Cette définition est bien sûr identique quel que soit l’âge. Son application à la personne très âgée appelle toutefois quelques remarques :
- la sensibilité et la spécificité de la symptomatologie de l’IDM diminuent grandement avec l’âge. Ainsi, l’absence de douleur thoracique est fréquente après 80 ans et ne doit évidemment pas faire récuser le diagnostic ;
- l’élévation de la Tnc au cours d’un épisode aigu, notamment infectieux ou autre, est trop souvent banalisée chez le sujet âgé, a fortiori s’il existe une cinétique ascendante ou descendante. Si elle ne témoigne pas nécessairement d’une nécrose myocardique, l’élévation de la Tnc est par contre spécifique d’une souffrance myocardique, ischémique ou non(13). Celle-ci est fortement corrélée à la mortalité dans nombre de situations non cardiologiques, notamment la pneumonie(14) ou l’anémie. Une élévation de la Tnc doit donc inciter à rechercher des symptômes et signes d’ischémie myocardique, cliniques bien sûr, mais également paracliniques. Outre l’électrocardiogramme, l’échographie cardiaque devrait être réalisée à la recherche d’une altération de la cinétique pariétale du myocarde. Force est de constater que cet outil reste largement sous-utilisé en population gériatrique.
La définition des IDM distingue l’IDM de type 2 de l’IDM de type 1 sur un principe physiopathologique clair reposant sur la présence ou non d’un événement athérothrombotique aigu(12). A l’opposé de l’IDM de type 1 secondaire à une obstruction mécanique plus ou moins complète du flux coronaire secondaire à un événement aigu de plaque, l’IDM de type 2 se définit comme la résultante d’un déséquilibre fonctionnel entre apports et besoins du myocarde en oxygène, en l’absence de processus athérothrombotique, aboutissant à la nécrose myocardique (Figure 2).
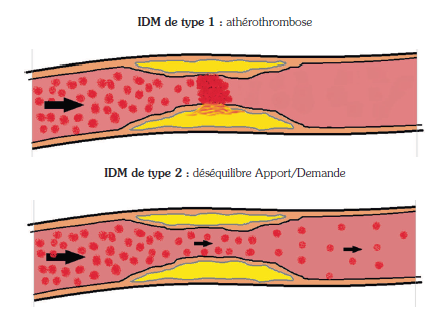
Figure 2 : Physiopathologie des infarctus du myocarde de type 1 et 2.
Figure 2: Pathophysiology of type 1 and 2 myocardial infarction.
L’IDM de type 2 est une pathologie fortement liée à l’âge dont la pathogenèse répond parfaitement au modèle de Bouchon(5). Elle résulte de la convergence entre :
- le processus de vieillissement cardiovasculaire, comprenant mais ne se le limitant pas au phénomène d’artériosclérose ;
- les pathologies chroniques prédisposantes, cardiaques et extracardiaques ; et enfin
- des facteurs précipitants aigus, le plus souvent accessibles à un traitement ou à une prévention(15). L’IDM de type 2 peut survenir chez des patients dont les artères coronaires sont normales ou plus souvent chez des patients atteints d’une maladie coronarienne préexistante. Rappelons que le diagnostic d’IDM, quel que soit le type, nécessite la présence de signes cliniques ou paracliniques d’ischémie. L’élévation isolée des Tnc, même en situation de déséquilibre entre apports et besoins en oxygène, correspond à une situation plus fréquente encore, de souffrance myocardique non ischémique(12). Il existe trois écueils principaux pour l’application pratique de cette définition physiopathologique.
- La mise en évidence du phénomène athérothrombotique ou de son absence n’est pas aisée en pratique. Aucun signe clinique ne permet d’orienter vers un tel processus. Le gold standard reste à ce jour la coronarographie, qui présente l’inconvénient majeur de rester une procédure invasive, avec des risques non négligeables chez le sujet très âgé, liés d’une part à l’injection de produit de contraste, mais aussi au risque per-procédure de dissection coronaire. De plus, cet examen n’a pas une sensibilité parfaite pour le diagnostic des accidents aigus de plaque(16).
- Les situations cliniques à l’origine de la pathogenèse de l’IDM de type 2, définies comme les situations où il existe un déséquilibre entre apports et besoins du myocarde en oxygène, ne font pas l’objet d’un consensus et ont été encore peu étudiées à grande échelle(17). Des critères spécifiques de déséquilibre entre apports et besoins en oxygène aboutissant à un IDM de type 2 ont été proposés dans plusieurs études. Le principal avantage de l’utilisation de critères stricts et spécifiques est la réduction de l’ambiguïté et de la subjectivité dans le diagnostic de l’IDM de type 2, permettant la reproductibilité du diagnostic par les cliniciens et les chercheurs. Toutefois, l’utilisation en pratique clinique de seuils précis de déséquilibre entre apports et besoins requis pour le diagnostic est de pertinence discutable, étant donné que l’ischémie est un processus multifactoriel qui dépend de multiples variables anatomiques et physiologiques(11). La plupart des études portant sur la survenue de l’IDM de type 2 ont donc utilisé des approches plus pragmatiques et plus proches de la réalité clinique pour déterminer les situations d’inadéquation entre offre et demande en oxygène cliniquement significatives.
- En réalité, la majorité des cas d’IDM de type 2 chez le sujet âgé correspond probablement à la coexistence d’un phénomène athérothrombotique avec une situation de déséquilibre fonctionnel de l’oxygénation myocardique, et la dichotomisation entre ces deux types physiopathologiques est d’utilité thérapeutique discutable.
Incidence
L’incidence des IDM connaît une croissance continue avec l’âge(18). Toutefois, cette augmentation concerne essentiellement les IDM de type 2, l’incidence des IDM de type 1 étant relativement constante après 50 ans (Figure 3). Les données épidémiologiques présentées dans ce travail sont issues de l’Observatoire des infarctus de Côte-d’Or (RICO), mis en place depuis le 1er janvier 2001(15). Cette large base de données colligeant près de 20 000 patients est représentative des IDM hospitalisés dans les unités de soins intensifs cardiologiques en France. L’âge à l’incidence diffère largement selon le type physiopathologique d’IDM. Les patients présentant un IDM de type 2 ont un âge moyen de 81 ans contre 67 ans pour ceux souffrant d’IDM de type 1 (Figure 4), sans prédominance de genre (contrairement à l’IDM de type 1 qui affecte majoritairement les hommes). Cette pathologie touche préférentiellement les personnes polypathologiques, avec notamment un terrain vasculaire fréquent. Dans la base du RICO, 75 % des patients présentant un IDM de type 2 ont une hypertension artérielle, 37 % une coronaropathie connue, 35 % un diabète et 25 % un antécédent de fibrillation atriale(15).
Pronostic
Contrairement à une idée intuitive, l’absence de phénomène athérothrombotique n’est pas corrélée à un meilleur pronostic. En effet, l’IDM de type 2 est associé à une mortalité toutes causes confondues de l’ordre de deux fois plus importante(16). Toutefois, cette surmortalité est surtout liée aux comorbidités sous-jacentes et, après ajustement, la mortalité cardiovasculaire à court terme semble peu liée au type physiopathologique(19).
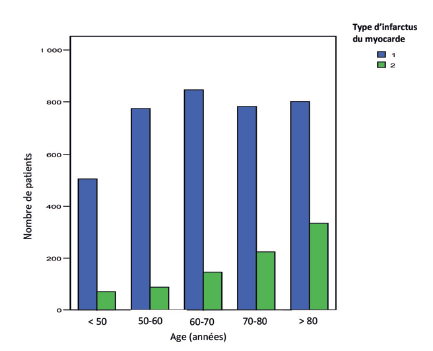
Figure 3 : Distribution par classe d’âge des infarctus du myocarde de type 1 (bleu) et de type 2 (vert) en unités de soins intensifs cardiologiques (données Observatoire RICO)(15).
Figure 3: Age distribution of type 1 (blue) and type 2 (green) myocardial infarctions in cardiac intensive care units (RICO Observatory data)(15).
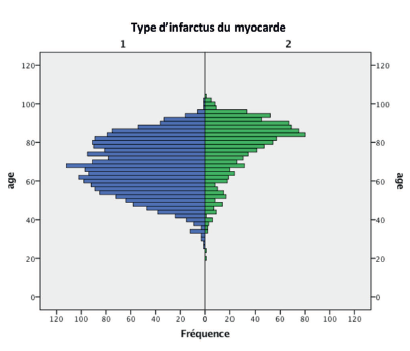
Figure 4 : Pyramide des âges des patients atteints d’infarctus du myocarde de type 1 (bleu) et de type 2 (vert) en unités de soins intensifs cardiologiques (Données Observatoire RICO)(15).
Figure 4: Age pyramid of patients with type 1 (blue) and type 2 (green) myocardial infarction in cardiac intensive care units (RICO Observatory data)(15).
Atypie sémiologique du sujet âgé
En pratique clinique, l’IDM du sujet âgé connaît des spécificités sémiologiques rendant son diagnostic fréquemment difficile. La douleur thoracique est plus rare, la symptomatologie moins typique, les modifications électrocardiographiques moins fréquentes(2,20). Bien souvent, la présentation clinique se limite à un tableau aspécifique de décompensation cardiaque(20). Le motif d’admission est fréquemment non cardiologique, le patient gériatrique consultant pour une plainte non évocatrice (chute, douleur diffuse, confusion…). Jusqu’à 60 % des IDM du patient très âgé seraient non diagnostiqués à la prise en soins initiale(2). Le délai entre le début des symptômes et le diagnostic est ainsi plus que doublé comparativement au patient plus jeune(21).
Diagnostic différentiel entre IDM de type 1 et de type 2
La distinction entre IDM de type 1 et de type 2 tient exceptionnellement du diagnostic de certitude. Il s’agit habituellement d’un faisceau d’arguments permettant d’établir une probabilité diagnostique raisonnable (Figure 5). Même lorsque la coronarographie est réalisée, elle ne permet pas toujours de distinguer la présence ou l’absence de phénomène athérothrombotique aigu.
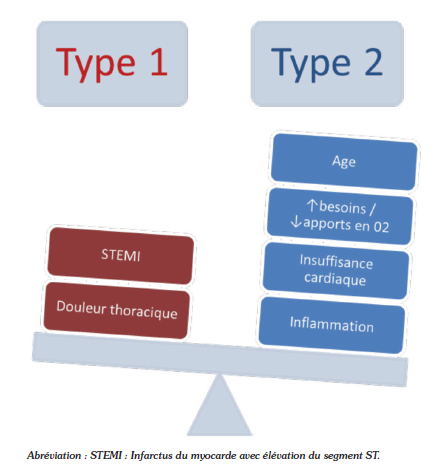
Figure 5 : Représentation schématique de la distinction pratique entre infarctus du myocarde de type 1 et de type 2.
Figure 5: Représentation schématique de la distinction pratique entre infarctus du myocarde de type 1 et de type 2.
Présentation clinique
La distinction entre IDM de type 1 et de type 2 est le plus souvent basée sur la clinique. Les éléments en faveur des deux diagnostics sont présentés en figure 6. La douleur rétrosternale et le sus-décalage du segment ST sont des éléments rares dans l’IDM de type 2, qui se présente plus volontiers sous la symptomatologie d’une insuffisance cardiaque aiguë.
Biomarqueurs
L’utilisation de biomarqueurs pourrait avoir un impact sur le différentiel entre IDM type 1 et type 2. Parmi ceux-ci, trois facilement accessibles en pratique clinique ont montré un fort pouvoir discriminant(22). La place de leur utilisation en pratique clinique reste à préciser. Ce sont :
- les Tnc qui sont nettement plus élevées en cas d’IDM de type 1 qu’en cas d’IDM de type 2. Ceci a été montré dans une étude issue de la base de données du RICO qui retrouvait les valeurs suivantes : 3 [1-14] vs 17 [3-68] mg/l, p < 0,001(15). Toutefois, quel que soit leur mode de dosage, par techniques conventionnelles ou par techniques ultrasensibles, le taux de Tnc, considéré seul dans la démarche diagnostique, garde un pouvoir discriminant limité entre IDM de type 1 et IDM de type 2(23,24) ;
- les peptides natriurétiques, notamment le N terminal Brain Natriuretic Peptide (Nt-proBNP) qui est le plus utilisé en pratique clinique, ont également un intérêt discriminant. En effet, le taux de Nt-proBNP est environ cinq fois plus élevé dans l’IDM de type 2 que dans l’IDM de type 115. Le rapport Nt-pro BNP/Tnc pourrait avoir un pouvoir discriminant intéressant(25) qui reste à confirmer à large échelle ;
- les marqueurs de l’inflammation, notamment la protéine C réactive (CRP), ont également été étudiés comme marqueurs de différenciation. L’élévation de la CRP (> 3 mg/l) concernerait jusqu’à près de 90 % des IDM de type 2(26). Le rapport CRP/Tnc a montré un bon pouvoir discriminant dans une étude prospective réalisée dans un service d’urgences, chez des patients aux antécédents de coronaropathie(26).
Place de la coronarographie
La coronarographie ne peut pas être réalisée systématiquement pour dissocier ces deux entités physiopathologiques, en particulier chez le patient âgé fragile pour lequel le risque iatrogène, en particulier en situation aiguë, doit être mis en balance avec le bénéfice attendu. La plupart des IDM de type 2 ne bénéficient donc pas d’une coronarographie, avec une grande variabilité entre les centres(16). L’intérêt de la coronarographie à la phase aiguë d’un IDM de type 2 reste à démontrer : cette question fait l’objet d’un essai randomisé en cours(27). L’âge toutefois ne doit pas justifier l’absence de coronarographie en cas de doute. Dans la mesure où elle modifie radicalement la prise en charge et le pronostic en cas de phénomène athérothrombotique, la coronarographie doit être réalisée en cas de forte présomption d’IDM de type 1 : sus-décalage du segment ST, douleur rétrosternale typique, absence de situation de déséquilibre entre apports et besoins en oxygène.
Enquête étiologique autour d’un infarctus de type 2
Saaby et al. ont été les premiers à clairement proposer un ensemble de critères étiologiques et de seuils pour l’adjudication de l’IDM de type 2, reflétant un déséquilibre entre l’offre et la demande en oxygène myocardique(28). Toutefois, ces critères reproductibles, utiles en recherche médicale, ne sont guère adaptés à la pratique clinique. L’enquête étiologique face à un IDM du sujet âgé présumé sans phénomène athérothrombotique nécessite pourtant une enquête étiologique exhaustive. Les principaux facteurs à l’origine d’un déséquilibre d’oxygénation du myocarde observés dans la base de données de l’observatoire RICO sont présentés dans le tableau 1. Le rétrécissement aortique serré est une des cardiopathies prédisposantes les plus fréquentes, associé à la fois à une diminution de la perfusion coronaire (l’ostium étant situé en aval de la valve aortique) et à une augmentation des besoins (hypertrophie ventriculaire gauche secondaire). L’anémie chronique sévère prédispose fréquemment à l’IDM de type 2 en population gériatrique, alors que l’anémie aiguë post-hémorragique peut être considérée comme un facteur précipitant. Comme le contexte épidémique actuel l’a rappelé, le facteur précipitant le plus fréquent reste de loin les infections, en particulier respiratoires, tant bactériennes que virales(29). La tachyarythmie, anciennement dénommée « fibrillation atriale anginogène », associée à la fois à une augmentation de la consommation en oxygène et à une diminution de la perfusion coronaire en diastole, est également un facteur précipitant fréquent, particulièrement utile à rechercher car des thérapeutiques rapidement efficaces pour la réduire ou la ralentir sont disponibles(30). Un arbre diagnostique face à une situation de souffrance myocardique du sujet âgé est proposé en figure 7.
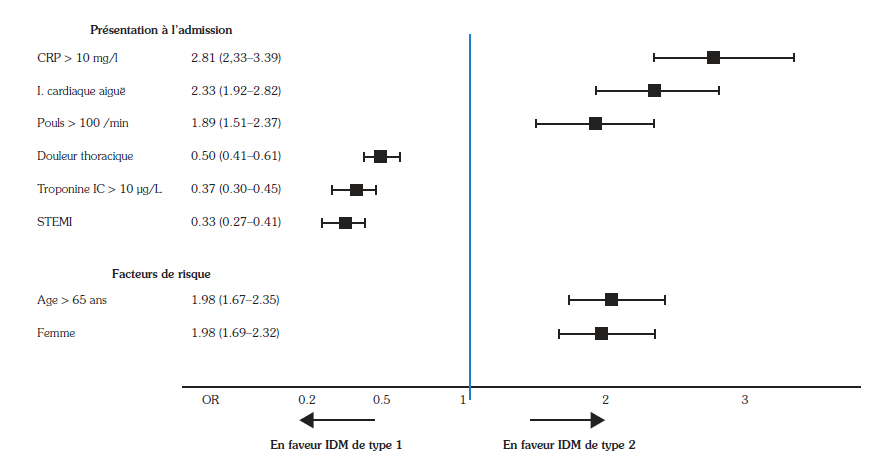
Figure 6 : Facteurs discriminants entre infarctus du myocarde de type 1 et de type 2 en unités de soins intensifs cardiologiques (données Observatoire des Infarctus de Côte d’Or)15.
Figure 6: Discriminating factors between type 1 and type 2 myocardial infarction in cardiac intensive care units (Côte d’Or Infarction Observatory data)(15).
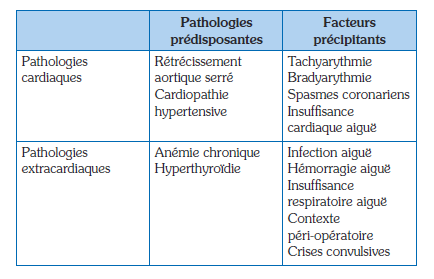
Tableau 1 : Principales pathologies associées à la pathogénie des infarctus du myocarde de type 2 (données Observatoire RICO).
Table 1: Main pathologies associated with the pathogenesis of type 2 myocardial infarction (RICO Observatory data).
Place de l’angioplastie
Au-delà de l’enjeu diagnostique, la prise en soins des patients âgés polypathologiques atteints d’IDM est elle-même spécifique et requiert une approche gériatrique globale, caractérisée par une perspective holistique, centrée sur le patient, son statut fonctionnel et sa qualité de vie31. Sur le plan thérapeutique, il existe à ce jour peu de données spécifiques à la population âgée. Plus de la moitié des études thérapeutiques dans l’IDM excluent les patients âgés de plus de 75 ans. La grande majorité des recommandations actuelles sont donc extrapolées d’études chez le sujet plus jeune(32,33). L’âge reste à ce jour un facteur indépendant de mauvais pronostic à court et à long termes(34,35). Toutefois, une stratégie invasive est associée dans les essais randomisés à un meilleur pronostic, y compris chez le sujet âgé de plus de 80 ans, dans l’IDM avec élévation du segment ST(36). L’intérêt de telles procédures est plus débattu en l’absence d’élévation du segment ST, mais les données les plus récentes sont en faveur d’une procédure invasive(37-39). Pour certains, le bénéfice des procédures de reperfusion semble même augmenter avec l’âge(40,41). Il existe toutefois de grandes disparités entre centres pour la prise en soin des patients les plus âgés, avec une moindre mortalité constatée dans les centres réalisant l’angioplastie(42). En France, la tendance est à une augmentation des procédures d’angioplastie primaire chez les patients les plus âgés, corrélée à une diminution nette de la mortalité à un an(43). À notre connaissance, l’intérêt d’un geste d’angioplastie dans l’IDM de type 2 n’a pas été évalué par des essais interventionnels. Toutefois, l’hétérogénéité des situations aboutissant au déséquilibre d’oxygénation myocardique nécessite vraisemblablement une approche étiologie par étiologie afin de définir la stratégie thérapeutique la plus adaptée. Quelques études observationnelles sont à ce jour disponibles dans l’IDM post-infectieux, retrouvant des résultats divergeant quant à l’intérêt des thérapeutiques invasives à la phase aiguë(44-46).
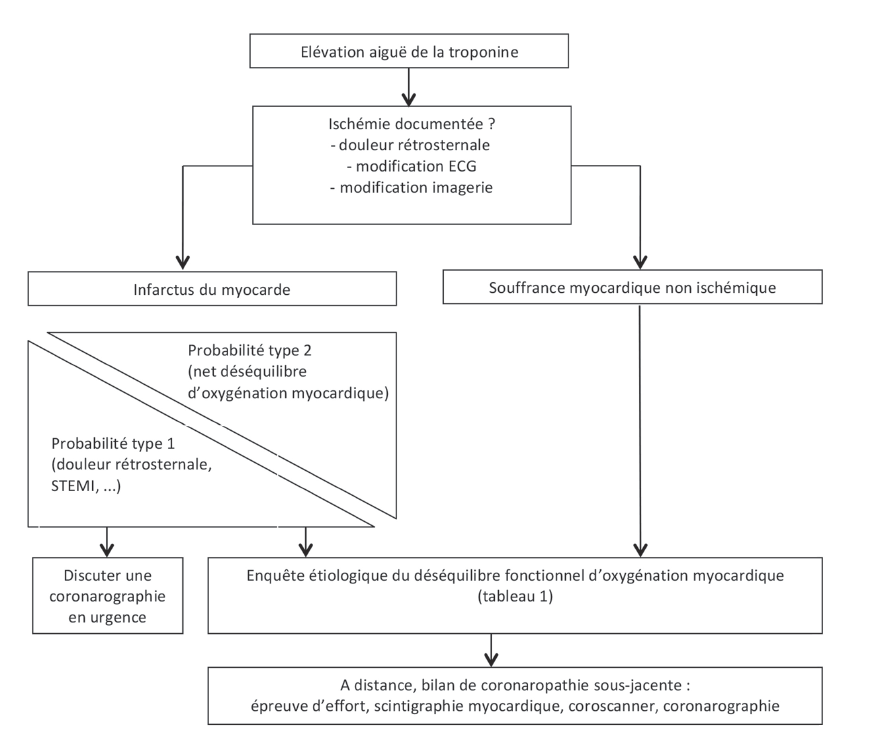
Figure 7 : Enquête diagnostique face à une situation de souffrance myocardique du sujet âgé.
Figure 7: Diagnostic investigation of myocardial pain in the elderly.
Thérapeutiques médicamenteuses
Faute d’étude interventionnelle spécifique, le traitement de l’IDM de type 2 ne connait à ce jour aucune recommandation de prise en soin(47). Selon la quatrième définition universelle de l’IDM, sa prise en charge repose sur le rétablissement de l’état d’équilibre entre besoins et apports en oxygène4. L’hétérogénéité des pathologies sous-jacentes à l’origine de ce déséquilibre implique là encore une approche spécifique par situation, au lit du malade comme en recherche médicale. À l’heure actuelle, il n’existe aucune donnée publiée pour recommander l’introduction d’un traitement antiagrégant plaquettaire à la phase aiguë d’un IDM de type 2, dont la physiopathologie par définition ne fait pas intervenir de phénomène athérothrombotique. Cependant, en absence de donnée thérapeutique spécifique, le type physiopathologique d’IDM ne devrait finalement pas avoir d’incidence thérapeutique sur le traitement cardiologique, car les recommandations actuelles à haut niveau de preuves sont basées non pas sur le type physiopathologique mais sur l’élévation ou non du segment ST(48,49). La prise en soin des IDM à coronaires saines, c’est-à-dire sans coronaropathie décelable, situation finalement assez rare en gériatrie, reste pour l’heure mal codifiée(49).
L’IDM sans évènement athérothrombotique aigu, ou IDM de type 2, est une pathologie éminemment gériatrique, du fait de l’âge avancé et des comorbidités fréquentes de la population concernée. De plus, cette pathologie est secondaire à un déséquilibre fonctionnel répondant au modèle gériatrique de pathogénie proposé par Bouchon, au coeur de notre discipline médicale. L’IDM de type 2 est en effet secondaire à un déséquilibre entre les apports en oxygène, devenus insuffisants, et les besoins, augmentés. Il résulte de la convergence entre :
- le processus de vieillissement cardiovasculaire, comprenant mais ne se le limitant pas à l’athérosclérose ;
- des pathologies chroniques prédisposantes, cardiaques et extracardiaques ;
- et enfin des facteurs précipitants, au premier rang desquels figurent les infections aiguës, notamment respiratoires. Des études prospectives interventionnelles, dont certaines sont en cours, s’avèrent essentielles afin de mieux appréhender l’attitude thérapeutique optimale face à un IDM de type 2. En l’absence d’efficacité démontrée des procédures invasives d’angioplastie, la prise en soin de ces IDM fonctionnels repose à ce jour essentiellement sur le traitement de leur cause, c’est-à-dire le rétablissement de l’équilibre entre apports et besoins en oxygène. Cela nécessite une approche étiologique au cas par cas, dans laquelle la collaboration entre cardiologue et gériatre a toute son importance. Des politiques préventives sont également souhaitables à l’avenir, parmi lesquelles les vaccinations antigrippale et antipneumococcique qui ont démontré leur efficacité en prévention des IDM post-infectieux. L’utilisation de médicaments cardioprotecteurs lors de situations très pourvoyeuses d’IDM de type 2, par exemple les infections respiratoires en population à haut risque cardiovasculaire, s’avère une autre piste prometteuse.
Remerciements : Les auteurs souhaitent remercier l’ensemble des collaborateurs de l’observatoire des Infarctus de Côte d’Or (RICO). Ce travail a été soutenu par le CHU de Dijon, l’Association de Cardiologie de Bourgogne, et par des subventions de l’Agence Régionale de Santé (ARS) de Bourgogne Franche Comté, et du Conseil Régional de Bourgogne Franche Comté.
Liens d’intérêts : les auteurs déclarent ne pas avoir de lien d’intérêt en rapport avec cet article.
1. de Peretti C, Chin F, Tuppin P, Danchin N. Personnes hospitalisées pour infarctus du myocarde en France : tendances 2002-2008. Bulletin Épidémiologique Hebdomadaire 2012 ; 41 : 459-65.
2. Gregoratos G. Clinical manifestations of acute myocardial infarction in older patients. Am J Geriatr Cardiol 2001 ; 10 : 345‑7.
3. Friedberg CK, Horn H. Acute myocardial infarction not due to coronary artery occlusion. JAMA 1939 ; 112 : 1675-9.
4. Thygesen K, Alpert JS, Jaffe AS, Simoons ML, Chaitman BR, White HD, et al. Third universal definition of myocardial infarction. Eur Heart 2012 ; 33 : 2551‑67.
5. Bouchon JP. 1 + 2 + 3 ou comment tenter d’être efficace en gériatrie ? Rev Prat 1984 ; 34 : 888‑92.
6. Scheen AJ. De l’athérosclérose à l’athérothrombose. Rev Med Liège 2018 ; 73 : 5-6.
7. Porth CM, Gaspard KJ. Essentials of pathophysiology: Concepts of altered health states. Fourth Edition. 2014. 1 p.
8. Shah SM, Pfau SE. Coronary Physiology in the Cardiac Catheterization Laboratory. J Clin Med 2019 ; 8 : 255.
9. Uren NG, Camici PG, Melin J, Bol A, Bruyne B, Radvan J. Effect of Aging on Myocardial Perfusion Reserve. J Nucl Med 1995 ; 36 : 2032-6.
10. Thijssen DHJ, Maiorana AJ, O’Driscoll G, Cable NT, Hopman MTE, Green DJ. Impact of inactivity and exercise on the vasculature in humans. Eur J Appl Physiol 2010 ; 108 : 845‑75.
11. Brown CJ, Redden DT, Flood KL, Allman RM. The underrecognized epidemic of low mobility during hospitalization of older adults. J Am Geriatr Soc 2009 ; 57 : 1660‑5.
12. Thygesen K, Alpert JS, Jaffe AS, Chaitman BR, Bax JJ, Morrow DA, et al. Fourth universal definition of myocardial infarction (2018). Glob Heart 2018 ; 13 : 305-38.
13. Cao Z, Zhao M, Xu C, Zhang T, Jia Y, Wang T, et al. Diagnostic Roles of Postmortem cTn I and cTn T in Cardiac Death with Special Regard to Myocardial Infarction: A Systematic Literature Review and Meta-Analysis. Int J Mol Sci 2019 ; 20 : 3351.
14. Putot A, Bouhey E, Tetu J, Barben J, Timsit E, Putot S, et al. Troponin Elevation in Older Patients with Acute Pneumonia: Frequency and Prognostic Value. J Clin Med 2020 ; 9 : E3623.
15. Putot A, Jeanmichel M, Chague F, Manckoundia P, Cottin Y, Zeller M. type 2 Myocardial Infarction: A Geriatric Population-based Model of Pathogenesis. Aging dis 2020 ; 11 : 108.
16. Sandoval Y, Jaffe AS. type 2 Myocardial Infarction: JACC Review Topic of the Week. J Am Coll Cardiol 2019 ; 73 : 1846‑60.
17. Sandoval Y, Thygesen K. Myocardial Infarction type 2 and Myocardial Injury. Clin Chem 2017 ; 63 : 101‑7.
18. Lee CH, Cheng CL, Yang YHK, Chao TH, Chen JY, Liu PY, et al. Trends in the incidence and management of acute myocardial infarction from 1999 to 2008: get with the guidelines performance measures in Taiwan. J Am Heart Assoc 2014 ; 3 : e001066.
19. Putot A, Derrida SB, Zeller M, Avondo A, Ray P, Manckoundia P, et al. Short-Term Prognosis of Myocardial Injury, type 1 and type 2 Myocardial Infarction in the Emergency Unit. Am J Med 2018 ; 131 : 1209-19.
20. Tisminetzky M, Gurwitz JH, Miozzo R, Nunes A, Gore JM, Lessard D, et al. Age Differences in the Chief Complaint Associated With a First Acute Myocardial Infarction and Patient’s Care-Seeking Behavior. Am J Med 2020 ; 133 : e501-7.
21. Ambepitiya G, Roberts M, Ranjadayalan K, Tallis R. Silent exertional myocardial ischemia in the elderly: a quantitative analysis of anginal perceptual threshold and the influence of autonomic function. J Am Geriatr Soc 1994 ; 42 : 732‑7.
22. Putot A, Cottin Y, Zeller M. Letter by Putot et al Regarding Article, “Biomarkers Enhance Discrimination and Prognosis of type 2 Myocardial Infarction”. Circulation 2021 ; 143 : e250-1.
23. Neumann JT, Sörensen NA, Rübsamen N, Ojeda F, Renné T, Qaderi V, et al. Discrimination of patients with type 2 myocardial infarction. Eur Heart J 2017 ; 38 : 3514‑20.
24. Sandoval Y, Thordsen SE, Smith SW, Schulz KM, Murakami MM, Pearce LA, et al. Cardiac troponin changes to distinguish type 1 and type 2 myocardial infarction and 180-day mortality risk. Eur Heart J Acute Cardiovasc Care 2014 ; 3 : 317‑25.
25. Nowak RM, Jacobsen G, Christenson RH, Moyer M, Hudson M, McCord J. Differentiating type 1 and 2 acute myocardial infarctions using the N-terminal pro B-type natriuretic peptide/cardiac troponin T ratio. Am J Emerg Med 2018 ; 36 : 1849‑54.
26. Putot A, Jeanmichel M, Chagué F, Avondo A, Ray P, Manckoundia P, et al. type 1 or type 2 Myocardial Infarction in Patients with a History of Coronary Artery Disease: Data from the Emergency Department. J Clin Med 2019 ; 8 : 2100.
27. Lambrakis K, French JK, Scott IA, Briffa T, Brieger D, Farkouh ME, et al. The appropriateness of coronary investigation in myocardial injury and type 2 myocardial infarction (ACT-2): A randomized trial design. Am Heart J 2019 ; 208 : 11‑20.
28. Saaby L, Poulsen TS, Hosbond S, Larsen TB, Pyndt Diederichsen AC, Hallas J, et al. Classification of Myocardial Infarction: Frequency and Features of type 2 Myocardial Infarction. Am J Med 2013 ; 126 : 789‑97.
29. Putot A, Chague F, Manckoundia P, Cottin Y, Zeller M. Post-Infectious Myocardial Infarction: New Insights for Improved Screening. J Clin Med 2019 ; 8 : 827.
30. Belkouche A, Yao H, Putot A, Chagué F, Rochette L, Danchin N, et al. The Multifaceted Interplay between Atrial Fibrillation and Myocardial Infarction: A Review. J Clin Med 2021 ; 10 : 198.
31. Ungar A, Rivasi G, Petrovic M, Schönenberger A, Martínez-Sellés M, Gasowski J, et al. Toward a geriatric approach to patients with advanced age and cardiovascular diseases: position statement of the EuGMS Special Interest Group on Cardiovascular Medicine. Eur Geriatr Med 2020 ; 11 : 179‑84.
32. Hanon O, Baixas C, Friocourt P, Carrié D, Emeriau JP, Galinier M, et al. Consensus of the French Society of Gerontology and Geriatrics and the French Society of Cardiology for the management of coronary artery disease in older adults. Arch Cardiovasc Dis 2009 ; 102 : 829‑45.
33. Rich MW, Chyun DA, Skolnick AH, Alexander KP, Forman DE, Kitzman DW, et al. Knowledge Gaps in Cardiovascular Care of Older Adults: A Scientific Statement from the American Heart Association, American College of Cardiology, and American Geriatrics Society: Executive Summary. J Am Geriatr Soc 2016 ; 64 : 2185‑92.
34. De Luca L, Marini M, Gonzini L, Boccanelli A, Casella G, Chiarella F, et al. Contemporary Trends and Age-Specific Sex Differences in Management and Outcome for Patients With ST-Segment Elevation Myocardial Infarction. J Am Heart Assoc 2016 ; 5 : e004202.
35. Kytö V, Prami T, Khanfir H, Hasvold P, Reissell E, Airaksinen J. Usage of PCI and long-term cardiovascular risk in post-myocardial infarction patients: a nationwide registry cohort study from Finland. BMC Cardiovasc Disord 2019 ; 19 : 123.
36. Damluji AA, Bandeen-Roche K, Berkower C, Boyd CM, Al-Damluji MS, Cohen MG, et al. Percutaneous Coronary Intervention in Older Patients With ST-Segment Elevation Myocardial Infarction and Cardiogenic Shock. J Am Coll Cardiol 2019 ; 73 : 1890‑900.
37. Tegn N, Abdelnoor M, Aaberge L, Endresen K, Smith P, Aakhus S, et al. Invasive versus conservative strategy in patients aged 80 years or older with non-ST-elevation myocardial infarction or unstable angina pectoris (After Eighty study): an open-label randomised controlled trial. Lancet 2016 ; 387 : 1057‑65.
38. Kaura A, Sterne JAC, Trickey A, Abbott S, Mulla A, Glampson B, et al. Invasive versus non-invasive management of older patients with non-ST elevation myocardial infarction (SENIOR-NSTEMI): a cohort study based on routine clinical data. Lancet 2020 ; 396 : 623‑34.
39. Phan DQ, Rostomian AH, Schweis F, Chung J, Lin B, Zadegan R, et al. Revascularization Versus Medical Therapy in Patients Aged 80 Years and Older with Acute Myocardial Infarction. J Am Geriatr Soc 2020 ; 68 : 2525-33.
40. Damluji AA, Resar JR, Gerstenblith G, Gross AL, Forman DE, Moscucci M. Temporal Trends of Percutaneous Coronary Interventions in Older Adults With Acute Myocardial Infarction. Circ Cardiovasc Interv 2019 ; 12 : e007812.
41. Damman P, Clayton T, Wallentin L, Lagerqvist B, Fox KAA, Hirsch A, et al. Effects of age on long-term outcomes after a routine invasive or selective invasive strategy in patients presenting with non-ST segment elevation acute coronary syndromes: a collaborative analysis of individual data from the FRISC II – ICTUS – RITA-3 (FIR) trials. Heart 2012 ; 98 : 207‑13.
42. Herrett E, Smeeth L, Walker L, Weston C ; MINAP Academic Group. The Myocardial Ischaemia National Audit Project (MINAP). Heart 2010 ; 96 : 1264‑7.
43. Puymirat E, Aissaoui N, Cayla G, Lafont A, Riant E, Mennuni M, et al. Changes in One-Year Mortality in Elderly Patients Admitted with Acute Myocardial Infarction in Relation with Early Management. Am J Med 2017 ; 130 : 555‑63.
44. Putot A, Chagué F, Manckoundia P, Brunel P, Beer JC, Cottin Y, et al. Post-Infectious Myocardial Infarction: Does Percutaneous Coronary Intervention Improve Outcomes? A Propensity Score-Matched Analysis. J Clin Med 2020 ; 9 : 1608.
45. Smilowitz NR, Gupta N, Guo Y, Bangalore S. Comparison of Outcomes of Patients With Sepsis With Versus Without Acute Myocardial Infarction and Comparison of Invasive Versus Noninvasive Management of the Patients With Infarction. Am J Cardiol 2016 ; 117 : 1065‑71.
46. Liu ES, Chiang CH, Hung WT, Tang PL, Hung CC, Kuo SH, et al. Comparison of long-term mortality in patients with acute myocardial infarction associated with or without sepsis. Int J Infect Dis 2019 ; 79 : 169‑78.
47. Sykes R, Briscoe M, Krysztofiak T, Peck O, Mangion K, Berry C. type 2 myocardial infarction and myocardial injury: eligibility for novel medical therapy to derisk clinical trials. Open Heart 2021 ; 8 : e001633.
48. Collet JP, Thiele H, Barbato E, Barthélémy O, Bauersachs J, Bhatt DL, et al. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: The Task Force for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J 2021 ; 42 : 1289‑367.
49. Ibanez B, James S, Agewall S, Antunes MJ, Bucciarelli-Ducci C, Bueno H, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J 2018 ; 39 : 119‑77.